| (8.1) |
Entropia jest termodynamicznym parametrem stanu układu. W interpretacji statystycznej, określa ona stopień nieuporządkowania układu, albo inaczej mówiąc, stopień jego wyjątkowości. Statystycznie określa się ją jako:
| (8.1) |
Gdzie ![]() jest jakąś stałą.
jest jakąś stałą. ![]() natomiast jest definiowane jako liczba
mikrostanów nieodróżnialnych od naszego makrostanu.
Z tego wynika np. że wazon ma małą entropię (nieuporządkowanie), natomiast
rozbite odłamki dużą (jest wiele możliwych realizacji rozbitego wazonu).
natomiast jest definiowane jako liczba
mikrostanów nieodróżnialnych od naszego makrostanu.
Z tego wynika np. że wazon ma małą entropię (nieuporządkowanie), natomiast
rozbite odłamki dużą (jest wiele możliwych realizacji rozbitego wazonu).
Interpretacja statystyczna jest ściśle związana z entropią znaną z teorii informacji. Tam używa się tego pojęcia do opisywania źródeł, generujących komunikaty. Entropia określa na ile nie potrafimy przewidzieć co źródło wygeneruje. Funkcja entropii musi spełniać 4 aksjomaty, warunkujące jej stosowalność jako miarę opisu nieokreśloności. Okazuje się, że jedyną postacią funkcji, jest tu
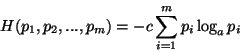 |
(8.2) |
Gdzie ![]() to prawdopodobieństwa wygenerowania przez źródła kolejnych
komunikatów.
to prawdopodobieństwa wygenerowania przez źródła kolejnych
komunikatów.
Z punktu widzenia przemian termodynamicznych, entropię definiuje się jako uogólnione przemieszczenie. Dla siły i pracy można napisać zależność:
| (8.3) |
Podobne równanie można zapostulować dla całkowitego pochłoniętego ciepła (odpowiednik pracy z powyższego wzoru) i jednostki napędowej (temperatura), zużytej na ,,uogólnionej drodze'' (entropii):
| (8.4) |
Przy czym ciepło całkowite jest równe ciepłu zużytemu na tarcie i rzeczywiście wchłoniętemu:
Można udowodnić, że entropia jest funkcją stanu. Tzn. nie zależy ona od drogi, po jakiej się do niej doszło.
Entropia jest jedną z zasadniczych wielkości używanych w termodynamice; jest treścią niezwykle ważnej, drugiej zasady termodynamiki, mówiącej że w przyrodzie entropia może jedynie wzrastać. Jeśli maleje lokalnie, to nie ma siły-w tym samym czasie gdzieś musi wzrosnąć, aby sumarycznie entropia nie malała.
Na ogół w przemianach termodynamicznych nie interesuje nas entropia jako
taka, ale jej zmiany. Sprawa jest podobna do energii potencjalnej: poziom
zerowy jest przyjmowany umownie. W przypadku entropii jest on zgodnie z
postulatem Plancka przyjmowany dla doskonałych kryształów na
poziomie temperatury ![]() , co umożliwia wyzerowanie stałej, obecnej w
interpretacji statystycznej. W temperaturze
, co umożliwia wyzerowanie stałej, obecnej w
interpretacji statystycznej. W temperaturze ![]() istnieje bowiem zgodnie z
zasadami fizyki kwantowej tylko jeden mikrostan (
istnieje bowiem zgodnie z
zasadami fizyki kwantowej tylko jeden mikrostan (![]() ).
).
Przy analizowaniu przemian termodynamicznych na wykresach, pole pod krzywą
entropii (na wykresie T-S) określa pochłaniane lub wydawane ciepło. Modelowe
obiegi termodynamiczne (silniki spalinowe, siłownie parowe) składają się w
dużej części przypadków z przemian izentropowych (lub prawie izentropowych)
(np. przemiana adiabatyczna-jeśli podstawić do wzoru 8.5 ,,brak
wymiany ciepła'', dostaniemy ![]() ) i przemian zwiększających entropię (np.
izotermiczna (w idealnym silniku Carnota i w siłowniach parowych),
izobaryczna i izochoryczna (w silnikach spalinowych-obiegi Otto i Diesla).
) i przemian zwiększających entropię (np.
izotermiczna (w idealnym silniku Carnota i w siłowniach parowych),
izobaryczna i izochoryczna (w silnikach spalinowych-obiegi Otto i Diesla).
Prześledźmy dla przykładu obieg Otto (rysunek 8.1). Z lewego dolnego rogu do góry następuje sprężanie adiabatyczne czynnika. Podwyższa się jego temperatura, ale proces jest na tyle szybki, że nie ma wymiany ciepła z otoczeniem. Następnie powstaje zapłon, mieszanka wybucha i izochorycznie (objętość tłoka jest stała, a szybkość wybuchu bardzo duża) oddaje ciepło (wzrasta ciśnienie). Następnie (odcinek pionowy prawy) następuje adiabatyczne rozprężanie spalin, a potem ich wydmuchnięcie i oziębienie w otoczeniu (dolny odcinek poziomy). Całkowita praca jest równa polu wewnątrz krzywej. Widać, że istnieją straty towarzyszące wydalaniu spalin.
From: Piotrus <mpit@_nospam_op.pl>
(zastrzeżenie: entropię można definiować również dla obiektów bez wymiany ciepła-przyp. PFG)
Jest sobie wyrażenie ![]() , które stanowiło dla termodynamików
problem - czemu?, bo nie jest funkcją stanu - czyli taką,
której wartość zależy nie od ,,drogi przejścia'' a od stanu
początkowego i końcowego danego procesu (np jest jakiś reaktor
przepływowy i nie wiadomo co się w środku dzieje - jak masz
funkcję stanu to zmierzysz parametry na wejsciu, na wyjściu
i coś wiesz, nie korzystając z funkcji stanu musiał byś analizować
,,środek'' reaktora) - matematycznie funkcja taka nie posiada
różniczki zupełnej, więc mądre głowy (dokładniej Clausius) szukały
wyrażenia, przez które pomnożona różniczka ciepła stała by się
różniczką zupełną (tzw. czynnik całkujący)
jednocześnie wyrażenie to powinno być zależne od jak najmniejsze
ilości termodynamicznych parametrów stanu (ciśnienie, temperatura,
objętość) czynnik ten pozwala określić funkcję stanu
, które stanowiło dla termodynamików
problem - czemu?, bo nie jest funkcją stanu - czyli taką,
której wartość zależy nie od ,,drogi przejścia'' a od stanu
początkowego i końcowego danego procesu (np jest jakiś reaktor
przepływowy i nie wiadomo co się w środku dzieje - jak masz
funkcję stanu to zmierzysz parametry na wejsciu, na wyjściu
i coś wiesz, nie korzystając z funkcji stanu musiał byś analizować
,,środek'' reaktora) - matematycznie funkcja taka nie posiada
różniczki zupełnej, więc mądre głowy (dokładniej Clausius) szukały
wyrażenia, przez które pomnożona różniczka ciepła stała by się
różniczką zupełną (tzw. czynnik całkujący)
jednocześnie wyrażenie to powinno być zależne od jak najmniejsze
ilości termodynamicznych parametrów stanu (ciśnienie, temperatura,
objętość) czynnik ten pozwala określić funkcję stanu ![]()
Co do filozofii wzrostu entropii pozwolę sobie napisać, że w przyrodzie są prawdopodobne tylko takie zjawiska, podczas których: suma przyrostów entropii wszystkich ciał uczestniczących w zjawisku jest większa od zera (to jest bardzo istotna różnica).
Są też inne definicje entropii, ale moim zdaniem podana wyżej może być traktowana jako pierwotna, gdyż to termodynamicy pierwsi zajęli się tym problemem a pojęcie entropii chyba właśnie w tej formie jest najszerzej stosowane (od rafinacji metali do analizy obiegów cieplnych).